代表の内田でございます。皆様、新年明けましておめでとうございます。
旧年中は大変お世話になりまして誠に有難うございました。
さて、今年最初のブログでは米国FDA(米国食品医薬品局)の医療機器相談業務についてお話させて頂ければと思います。
FDAで医療機器の薬機承認を取る。皆さんはそれを聞いてどのような印象を持たれますでしょうか。ある方は「FDAなんで敷居が高すぎて。。。」仰っていました。私はFDAで医療機器の審査官として働いていましたので、内情も分かりますし、FDAの敷居が高いとは全く思いませんが、対外的にはそういうものなのかもしれませんね。しかし、だからといって、敬遠しているばかりではいつまでたっても日本発の医療機器が米国に展開出来ません。どうやってFDAに近づけばいいのでしょうか。1つの方法としてFDAにも日本のPMDAの薬事相談のような制度が有り、それを利用する手があります。今回は簡単にそれをご紹介致します。
医療機器の開発で問題になるのは期間とお金が他の開発フェーズに比べると圧倒的にかかるので臨床試験/治験のフェーズであることが多く、このためFDAは1995年に「Pre-IDE」という相談の仕組みを作って相談業務を開始しました。IDEはInvestigational Device Exemptionの略で、日本で言えば治験届に近いものです。しかし、実際に医療機器の開発者がFDAに相談したいことはもっと多岐に渡っており、例えば、PMA(※1)申請に関する内容であったり、希少疾病用医療機器いわゆるオーファンデバイスに関するものであったり、510(k)申請に関するものであったりします。このために、FDAは2012年~2014年にかけてFDAの相談制度を大幅に変更しました。2014年2月、FDAはこの新しい相談業務のためのガインダンスドキュメント「Requests for Feedback on Medical Device Submissions: The Pre-Submission Program and Meetings with Food and Drug Administration Staff(医療機器申請に関するフィードバックのリクエスト:申請前プログラムおよびFDA職員とのミーティング」を発行しています。
「Q-Sub」の定義
FDAはこの新しい相談制度のために「Q-Sub」という新しい用語を作りました。Q-Subでは正式な相談資料がFDAに受領されるとQから始まり、暦年の2桁の数字が続く4桁の相談番号が付与されます。例えば、2014年に7番目に申請されたQ-Subには、番号Q140007が付与されます。この番号が付与されると、FDAとのコミュニケーションがいよいよ本格的に始まることになります。一旦終わったQ-Subについて、再度相談したいことがあるが、その場合はサプルメントのSをつけてQ140001/S001というように番号が付与されます。
Q-Subの利用方法
実際のQ-Subの仕組みについては下図がわかりやすいと思います。
(http://www.medtecjapan.com/ja/news/2014/02/26/1027(2017年1月1日時点アクセス確認)に掲載の図を改変)。
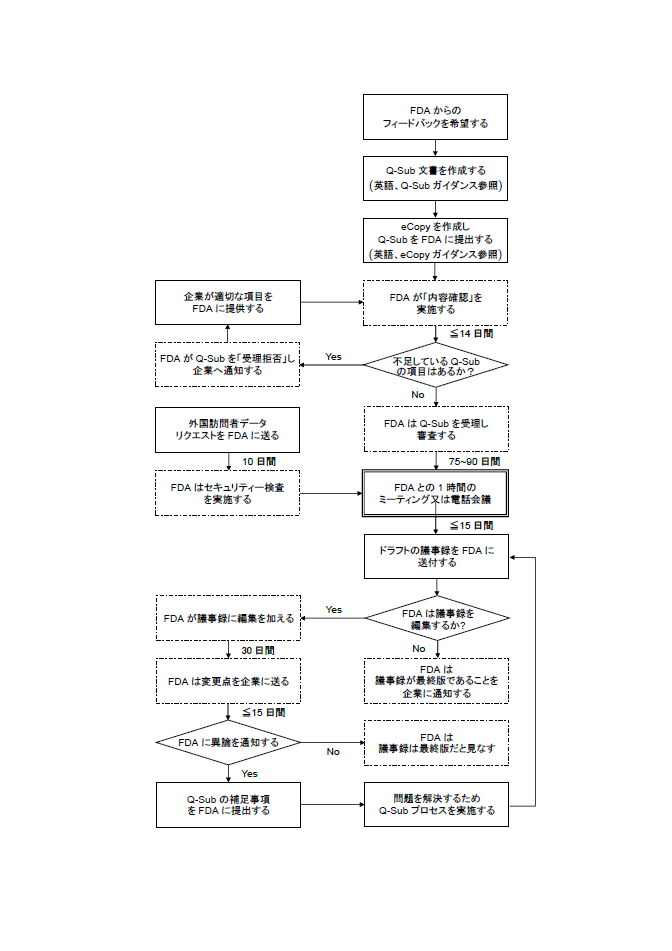
利用手順ですが、まず、Q-Sub は英語で書かれていなければなりません。次に、各Q-Subに対して「eCopy」(電子コピー)をFDAに送付します。eCopyについては別のFDAガイダンスドキュメント(eCopy Program for Medical Device Submissions – Guidance for Industry and Food and Drug Administrat)が参考になります。
Q-Subは日本人でも申し込むことができますが、勿論、現地の代理人やコンサルタントが申し込むこともできます。実際の相談は直接の面談か電話会議を選ぶことができます。面談の時間について、FDAは1時間が適当であると考えており、もしももっと時間が掛かりそうだと思う場合には予めその理由を申し出るよう求めています。実際に現地で面談に望む場合、FDAのセキュリティは厳しく、日本人の場合、外国人用の申請用紙(FDAのサイトからダウンロード可)を提出しておく必要があることに注意しましょう。
Q-subの種類
Q-Subにはいくつかの種類があり、その概要について下表にまとめました。
*公衆衛生上緊急の問題がある場合には21日
Q-Subの際に必要な情報
実際のQ-Subの申し込みに際しては下記のような内容が必要となります。
・カバーレター(Q-Subの理由を含む)
・目次
・機器の概要(外観、図面、作用機序、類似機器との比較、製造法の概要、素材の情報、類似機器との比較、場合よってはサンプルそのものなど)
・機器の適応
・これまでのFDAとのコミュニケーション結果
・製品開発計画(計画中あるいは実施された臨床・非臨床試験の概要)
・臨床試験のプロトコール(必要に応じて。IDEのためのPre-Subであれば詳細に)
・その他、相談したい内容
・希望するフィードバックの方法(対面の面談、電話会議、FAX、電子メールなど)
以上、簡単にFDA Q-Subに関する概要をガイダンスドキュメントの内容を中心に紹介しました。詳細は上述のガイダンスドキュメントを参照されると良いと思います。このようにFDAの薬事対応についてはほとんどホームページに情報が掲載されています。この点はFDAは対外的にとてもフレンドリーです。実際のQ-Subでも、FDAはリーズナブルだと思いますが、時々、相談者との間でミスコミュニケーションがある場合があります。FDAとミスコミュニケーションで揉めることはあまり得策ではありませんので、実際にQ-Subを行う場合には、やはり実務経験のある良いコンサルタントを利用することが現実的かもしれませんね。
弊社のFDA相談事例やお問い合わせは薬事品質保証コンサルティング紹介ページをご覧ください。
※1 Premarket approvalの事。Classが高い医療機器の承認プロセス
