2018.03.15
こんにちは。JOMDDで事業開発とソーシングを担当している志々目(ししめ)です。
本日は弊社で重要な領域のひとつとして位置づけている再生医療を題材に最新の事業化状況を俯瞰してみようと思います。
1. 再生医療とは
再生医療は法令によると以下のように定義されています。
再生医療は法令によると以下のように定義されています。
(1)人又は動物の細胞に培養等の加工を施したものであって、
イ 身体の構造・機能の再建・修復・形成するもの
ロ 疾病の治療・予防を目的として使用するもの
(2)遺伝子治療を目的として、人の細胞に導入して使用するもの
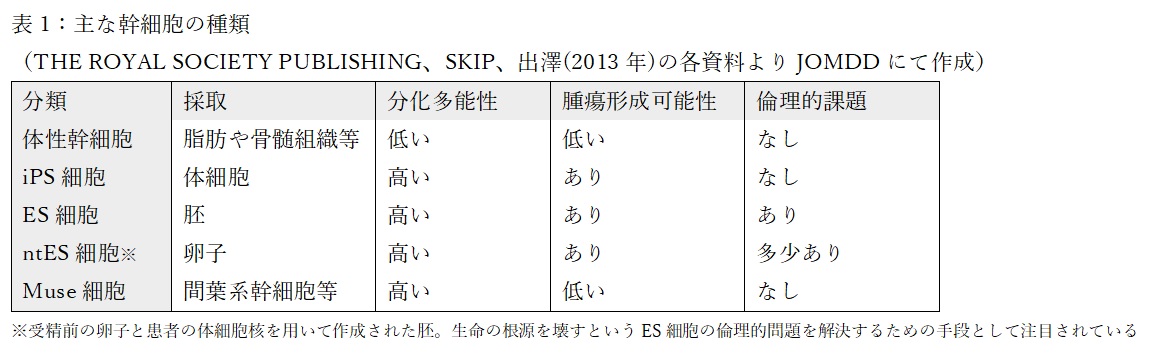
この再生医療への応用が期待されているもののひとつに、2012年に京都大学の山中教授がノーベル賞を受賞したことで有名になったiPS細胞があります。山中教授は2006年に発表した論文でマウスの皮膚細胞に4つの遺伝子(Oct3/4, Sox2, Klf4, c-Myc)をウイルスベクターで導入することで、マウスの体細胞から多能性を有したiPS細胞に初期化できることを発表しました。2007年にヒトでの再現に成功し、実用化へ向けた研究が今日まで盛んに行われています。この研究によってiPS細胞から体性幹細胞へと分化させ、更に標的組織への分化・誘導することにより、これまで不可能と言われていた損傷臓器の修復や難病の治療の実現が飛躍的に近づいたと言えます。このiPS細胞の他に、多能性幹細胞と呼ばれる幹細胞はいくつかの種類があり、相対的に開発が進められています。表1に幹細胞の種類と特徴をまとめました。
2. 実用化の状況
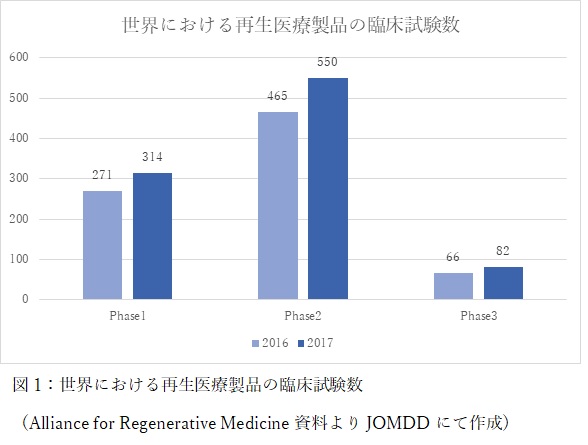
再生医療の実用化の状況を見ていきます。図1は世界の再生医療製品臨床試験の数を示しました。
再生医療の実用化の状況を見ていきます。図1は世界の再生医療製品臨床試験の数を示しました。
Alliance for Regenerative Medicineによると2017年末時点で946の臨床試験が世界で進行中であることが報告されています。前年の802試験から比べると飛躍的に増加しています。各フェーズで見ていくとPhase-1:314試験、Phase-2:550試験、Phase-3:82試験が進行中で全てのフェーズにおいて増加傾向にあることがわかります。
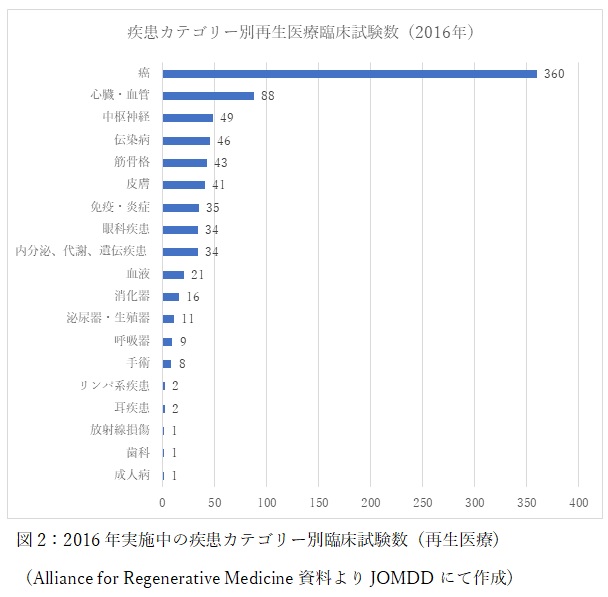
さらに、臨床試験を疾患別にみてみましょう(図2)。
さらに、臨床試験を疾患別にみてみましょう(図2)。
実施中の再生医療関連の臨床試験のうち、疾患別では癌が最も多く45%を占めています。次いで心疾患が10%強を占めており、有効な治療法が少なく、死亡数の多い疾患の治療において期待されています。FDAによるとPhase3の臨床試験のうち、25-30%が承認に至る見込みであるとされており、今後も安定して上市数が増えていくことが予測できます。
既に上市されている品目ですが、世界ではこれまでに約60品目が市販されています。日本もこうした動きを踏まえ、2013年の薬事法改正により、承認審査期間が大幅に短縮されています。有効性と安全性の確認がなされれば、市販後に更なる有効性と安全性を検証することを前提として条件・期限を付与して早期に再生医療等製品が上市できるようになりました。今後は規制緩和の効果が期待されますが、再生医療等製品については、2018年現在では国内でも各領域で臨床試験が実施中であるものの、日本で承認・上市されているものは以下の4製品に限られます(表2)。
世界的に同様の傾向であるものの、上記に挙げた製品はいずれも他に治療法が乏しく、且つ重篤な疾患に用途が限られています。また治療においても高度な経験と技術が医療従事者に求められ、高いレベルの設備が整った病院に提供が限られているのが現実です。その上これらの製品の多くは拒絶反応のリスクが低い自家由来細胞を用いて培養されているため、費用も数百万から数千万に上ってしまいます。そのため、培養効率を上げる技術や細胞バンクの導入が必要とされていますが、産業としての確立はまだまだこれからといったところです。
加えて、再生医療等製品は目的、投与方法によって規制区分が医薬品、医療機器に分かれることになります。主に注射での使用になると公定薬価が設定され、薬事審査も医薬品として進められる一方、細胞シートは特定保険医療材料扱いとなるので医療機器としての扱いになります。現在日本で使用されているテムセルHS(JCRファーマ)とハートシート(テルモ)は両製品とも新規の再生医療等製品として上市され、原価計算方式によって価格が決まりましたが、その際に参考とされる営業利益率は医薬品で約15%、医療機器(特定保険医療材料)では約7%と大きく水準が異なります。また、さらに細胞そのものから、臓器を形成するものまで、多種に渡ります(図3)。従って、事業として成り立たせるためにはどの疾患領域でどういった形で製品化させるか慎重に検討しなければなりません。
3. まとめ
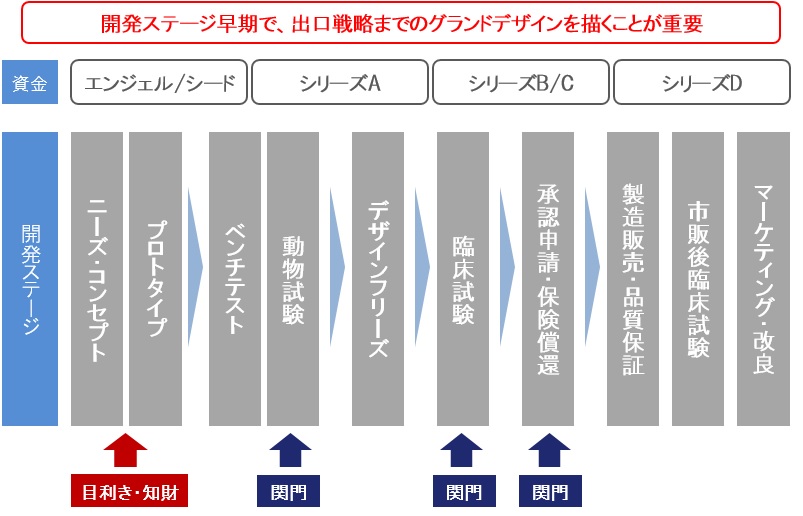
JOMDDでは研究者の皆様から受けた相談を基に行う自社開発、ベンチャー企業投資を問わず、開発ステージの初期からExitまでを見越した上市プランを立てた上で継続的な事業推進・支援を行ってきました。
JOMDDでは研究者の皆様から受けた相談を基に行う自社開発、ベンチャー企業投資を問わず、開発ステージの初期からExitまでを見越した上市プランを立てた上で継続的な事業推進・支援を行ってきました。
図3:JOMDD資料
再生医療では日本は上市数で先頭を走る韓国、アメリカ、ドイツに大きく後れを取っていますし、今後は海外の再生医療等製品・技術の日本への導出、並びに国内上市品の世界展開の2方向からの事業化を促していかなければなりません。インキュベーターとしてJOMDDの立ち位置は今後も変わらず、国内医療環境の充実と日本発技術を世界に広めるべく役割を果たしていきます。
【参考文献】
1. 独立行政法人医薬品医療機器総合機構(PMDA)
https://www.pmda.go.jp/ (最終アクセス2018年3月13日)
2. THE ROYAL SOCIETY PUBLISHING
PHILOSOPHICAL TRANSACTIONS OF THE ROYAL SOCIETY B『access Stem cell therapy: an exercise in patience and prudence』
http://rstb.royalsocietypublishing.org/content/368/1609/20110334 (最終アクセス2018年3月13日)
3. SKIP(Stemcell Knowledge & Information Portal)
https://www.skip.med.keio.ac.jp/knowledge/basic/06/(最終アクセス2018年3月13日)
4. 出澤真理「ヒト生体内に内在する新たな多能性幹細胞 Muse細胞:細胞治療、予後の診断、創薬、病態解析への展開の可能性」(『人工臓器』42巻1号、2013年、18ページ)
www.jsao.org/image/custom/pdf/42_1PDF/42_16.pdf(最終アクセス2018年3月13日)
5. Alliance for Regenerative Medicine
https://alliancerm.org/(最終アクセス2018年3月13日)
1. 独立行政法人医薬品医療機器総合機構(PMDA)
https://www.pmda.go.jp/ (最終アクセス2018年3月13日)
2. THE ROYAL SOCIETY PUBLISHING
PHILOSOPHICAL TRANSACTIONS OF THE ROYAL SOCIETY B『access Stem cell therapy: an exercise in patience and prudence』
http://rstb.royalsocietypublishing.org/content/368/1609/20110334 (最終アクセス2018年3月13日)
3. SKIP(Stemcell Knowledge & Information Portal)
https://www.skip.med.keio.ac.jp/knowledge/basic/06/(最終アクセス2018年3月13日)
4. 出澤真理「ヒト生体内に内在する新たな多能性幹細胞 Muse細胞:細胞治療、予後の診断、創薬、病態解析への展開の可能性」(『人工臓器』42巻1号、2013年、18ページ)
www.jsao.org/image/custom/pdf/42_1PDF/42_16.pdf(最終アクセス2018年3月13日)
5. Alliance for Regenerative Medicine
https://alliancerm.org/(最終アクセス2018年3月13日)
本記事に記載されている社名、製品名は各社の登録商標または商標です